祝贺XMECP程序介绍文章在J. Chem. Theory Comput.发表并入选ACS编辑良择!
Congratulations to Introduction Article of XMECP Published in J. Chem. Theory Comput. as ACS Editors’ Choice!
Jiawei Xu
Released: 2024-05-12 / Updated: 2024-05-12
(原文载自:福建物构所多尺度复杂体系极小能量交叉点优化程序最新进展入选美国化学会ACS Editors’ Choice)
多态反应是一类广泛存在于金属酶催化、光化学弛豫、电子转移等过程中的独特化学反应。准确描述多态反应中的态与态之间的转换过程,对理解阐释相关化学反应机制至关重要。通过定位极小能量交叉点(minimum energy crossing point, MECP),可以从能量和结构的角度讨论态与态之间的转换过程。相比于难度高、计算代价昂贵的非绝热分子动力学等方法,直接优化MECP可以在不损失关键化学信息的前提下简便地获得反应途径的能量和拓扑信息,是深入理解多态反应的一个重要工具。
现有的量化计算程序可较为广泛地支持采用各类量子力学(QM)方法优化MECP结构,但对于生物、材料等复杂体系,全QM计算的代价一般无法接受,因而兼顾化学反应环境影响因素和计算精度效率的组合量子力学/分子力学(QM/MM)等多尺度计算方法成为了该领域的主要关注对象。目前尚没有公开的量化计算程序能较好地实现在多尺度QM/MM级别下优化MECP结构,以满足研究生物蛋白环境、溶液或材料的体相环境对MECP和多态反应影响的需求。为解决相关科学问题,中国科学院福建物质结构研究所李春森课题组开发了能够在多尺度体系QM/MM级别下优化MECP结构的XMECP程序,该工作以题目“XMECP: Reaching State-of-the-Art MECP Optimization in Multiscale Complex Systems”发表在理论计算化学的权威刊物Journal of Chemical Theory and Computation上,并入选ACS Editors’ Choice亮点文章,作为头条新闻在美国化学会网站报道。
文章系统描述了MECP优化的算法和注意事项,通过多个应用案例展示了如何使用XMECP研究复杂生物体系的多态反应。
(1)使用XMECP程序研究胞嘧啶-腺嘌呤碱基对的光致质子耦合电子转移反应,发现远离反应中心的核苷酸残基通过π-π堆积的非共价相互作用链对非绝热耦合矩阵元产生贡献,从而促进反应中心的非绝热跃迁过程。
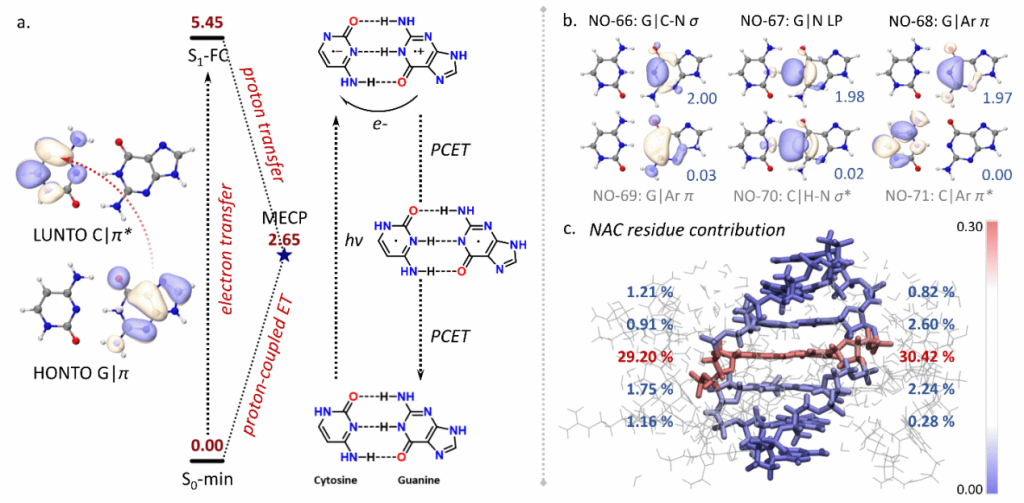
图1. 胞嘧啶-腺嘌呤碱基对光致质子耦合电子转移的机理,其中远离活性中心的残基沿着DNA中π-π堆积链对非绝热耦合矩阵元产生贡献,并随距离衰减。
(2)在含铁的2-氧代谷氨酸依赖双加氧酶活化氧气的机理研究中,使用XMECP程序可以计算定位到三重态-五重态交叉,描绘了静息态的金属酶活性中心结合三线态氧后演进到产物所在的五重态势能面的多态反应图景,同时发现距离活性中心较远的不直接参与反应的精氨酸残基通过两组氢键作用对旋轨耦合矩阵元存在相对大的贡献。
以上两例结果表明,在复杂生物蛋白环境中,远离生物酶活性中心的残基可通过非共价相互作用链对非绝热耦合或旋轨耦合矩阵元产生显著贡献,从而影响活性中心发生的非辐射跃迁过程。
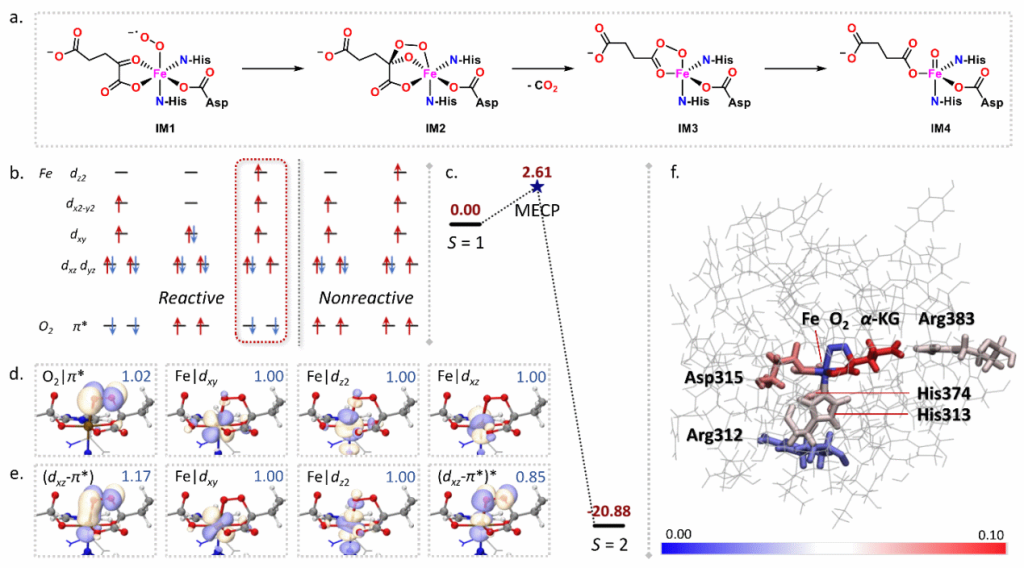
图2. 含铁的2-氧代谷氨酸依赖酶活化氧气的机理,其中不直接参与反应的Arg383残基通过两组氢键对旋轨耦合矩阵元产生了显著的贡献,甚至高于活性中心的铁氧物种。
(3)应用XMECP程序研究了不同电场强度对黄素蛋白光敏化机理的影响,结果表明黄素蛋白能在较大电场强度变化范围内保持功能稳定,阐释了广泛存在于生物体内的黄素蛋白虽然结构各异,内建电场对FMN或FAD辅因子作用不同,但其功能却都相仿的可能原因。
XMECP在研究复杂多尺度体系(如生物酶、材料、聚合物等)的多态反应中具有重要的应用价值,尤其是为相关领域的研究工作者提供了简单便捷的工作流程。开发者未来将进一步完善和发展XMECP程序的功能,以期更便捷、更精准地阐释复杂多尺度体系中MECP及相关化学机制问题。
中国科学院福建物质结构研究所硕士生徐嘉伟为论文的第一作者,张敏熠副研究员和李春森研究员为论文的共同通讯作者。该工作得到国家自然科学基金和福建省自然科学基金等项目的支持。
ACS Editors’ Choice®是美国化学会(ACS)通过其旗下90余本期刊的专业编辑评议挑选,每天在ACS网站在线发布一篇具有广泛科学意义的同行评审新文章作为头条推荐。按ACS在2023年发表6万多篇论文数量计算,入选ACS Editors’ Choice的文章比例不到1%。

